新藥
,
晟德
,
林榮錦
,
腦中風
,
授權
,
美國
,
中國
,
腎臟病
,
動物
,
試驗
新藥
,
晟德
,
林榮錦
,
腦中風
,
授權
,
美國
,
中國
,
腎臟病
,
動物
,
試驗
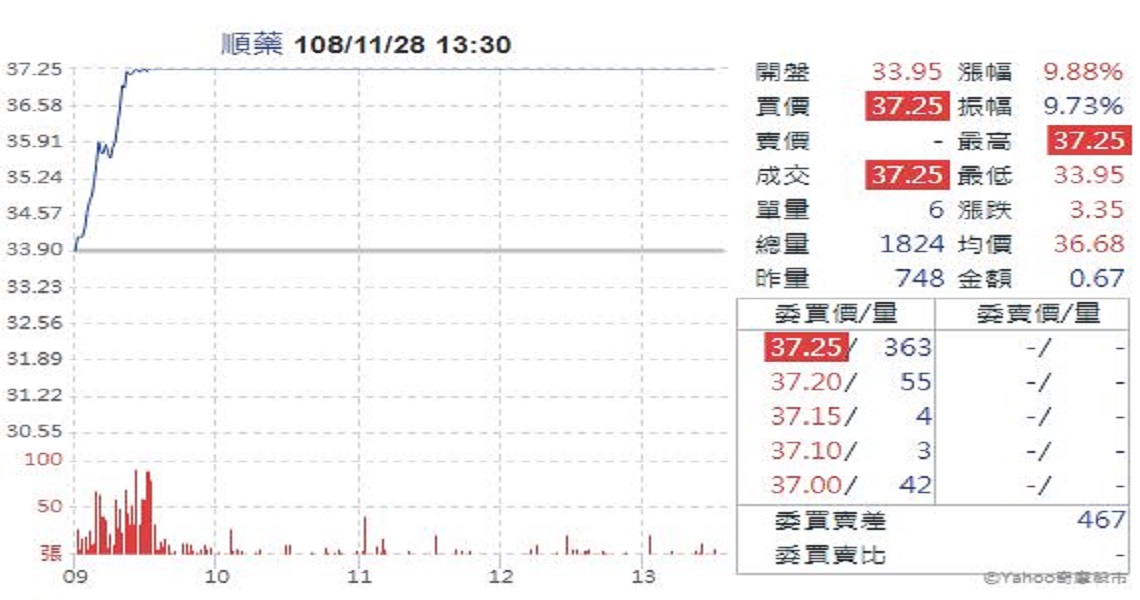
新藥研發公司順藥(6535)近期頻釋利多,國內新藥開發教父級推手-晟德(4123)生技集團掌門人暨順藥總經理林榮錦指出,今年(2019)許多台灣生技公司面臨資金斷流危機。然而,順藥歷經1年再造,已完成短中長期產品佈局,可望成為財務自主、具有永續產品線的新藥研發平台。
林榮錦日前在法說會指出,順藥將持續引進具有獲利潛力的早期新藥,成為學研單位與合作伙伴可信賴的新藥研發平台。日前與上海醫藥簽署授權協議的腦中風新藥LT3001,可望成為順藥研發平台所推出的第一個世界級重磅新藥。
順藥去年(2018)與金樺合併,成為具備大小分子藥物產品線的新藥研發公司。林榮錦去年接任總經理後,即帶領團隊盤點公司既有產品線,進行產品研發策略聚焦、強化財務風險控管,並建立與國內頂尖學研單位的合作網絡,透過重整及擴編業務發展團隊,強化對外授權,拓展產品授權合作,來平衡財務與產品研發的風險。歷經一年,其營運綜效已經顯現。今年以來主要產品線陸續均有相當之進展。
順藥第一個上市的新藥產品是長效止痛針劑LT1001,於2017年取得台灣衛福部食品藥物管理署(TFDA)藥證,2018年在台銷售已經突破萬針,2019年前10月更強勁成長7成。LT1001止痛效果類似嗎啡,卻沒有鴉片類止痛藥成癮帶給病患的種種危害,導致市場對這種新型疼痛管理藥物的選擇需求節節升高。
在授權進展方面,今年以來 LT1001已陸續有瑞士、中國大陸授權案,另有數個國家正積極洽談授權中。
LT1001日前已獲得美國食品藥品監督管理局(US FDA)默示許可,將在美國進行「相對生體可用率藥動學試驗」(Comparative Bioavailability study),此一試驗可銜接LT1001在台,以及其已在美上市的母藥納布啡(Nalbuphine)之臨床數據。該試驗完成後,順藥即可與未來授權公司合作,完成505(b)(2)途徑所需的第三期確認性臨床試驗,進而申請上市。
順藥預計於2020年啟動與潛在美國合作伙伴進行授權談判,以利LT1001早日在美上市,競逐1年約71億美元的疼痛管理用藥龐大市場;預計此一試驗完成後,將可加快授權談判的腳步。
此外,台灣與東南亞的授權伙伴安美得,亦積極擴充其適應症,在台灣使用的科室已經由痔瘡手術拓展至產科(剖腹產)、婦科、腹腔手術,今年則切入骨科,且積極申請東南亞藥證,已經於2019年7月向新加坡提出申請。而授權美國Skyline Vet Pharma的動物藥部分,也將於年底前,進行上市前的樞紐臨床試驗,可望於2020年取得美國動物藥藥證。
至於被寄予厚望的急性缺血性腦中風重磅新藥 LT3001,則將進入臨床二期,並已經與上藥醫藥集團,簽署授權協議。除台灣與美國外,也將在中國大陸啟動臨床試驗。
LT3001授權上藥對順藥而言別具意義。由於上藥將負擔大陸臨床試驗費用,將大幅降低順藥的財務風險;具有跟國際頂尖藥廠合作經驗的上藥,將與順藥共享大陸臨床試驗資料,合作爭取國際授權,不僅可加速授權腳步,也透過此一模式建立,達到分攤產品開發風險,提前實現智財價值,達到與合作伙伴互利共享的效益。
值得注意的是,順藥今年新開發的產品線,洗腎止癢(尿毒性搔癢)新藥LT5001以及標靶抗癌新藥LT2003,也將進入臨床試驗階段。
洗腎病人因慢性腎臟病 (Chronic kidney disease, CKD)以及末期腎臟病患者(end-stage renal disease, ESRD)會引起的尿毒性搔癢,造成相當大的不適。根據國際研究,血液透析患者約有42%的患者備受中度至嚴重的尿毒搔癢症症狀困擾,大幅影響生活品質,然目前仍無有效治療方式。
LT5001目前在動物試驗中已證實具有至少4小時的止癢效果,並透過人體試驗證實LT5001能有效經皮吸收(吸收率約10%)。順藥預計將在2019年底向TFDA申請phase Ib/II期臨床試驗。
至於蛋白融合抗癌新藥LT2003,則是承接自金樺的融合蛋白新藥開發平台的第一個產品。融合蛋白的設計,一端可辨識癌細胞的表皮生長因子受體(EGFR),另一端則為酵素,可將安全的前驅藥物5-FC (5-fluorocytosine)在腫瘤處轉化為具有毒殺效果的5-FU(5-fluouracil),達到針對專一靶點,結合化療藥物毒殺癌細胞的效果。順藥預計於2020年,為LT2003申請IND。
展望明年,順藥將不斷擴大與挖掘長效止痛針劑LT1001的收益,並積極洽談個別區域的授權,充實財務結構。LT3001則持續進行台灣、美國與大陸的二期臨床試驗,並積極洽談國際授權。洗腎止癢新藥(尿毒性搔癢)LT5001與融合蛋白標靶抗癌新藥LT2003亦將將進入臨床試驗階段。
此外,順藥也將衡量風險承受能力,透過靈活的策略聯盟,與頂尖學研單位合作,引進早期階段的產品線,使順藥成為高效率、財務健全,且具永續獲利能力的新藥研發公司。

理財工具推薦
下載Money錢 - 理財知識隨身讀APP
提供最優質的財經文章、影音
1.股市、保險、房地產,掌握最新財經動態 2.專家、名人駐站,提供深度產業分析 3.課程、影音專區,讓動手深度學習 下載【Money錢 - 理財知識隨身讀】,提前預約財富自由!